Feilslått EU-strategi truer norsk helsekvalitet
Dagens realitet er at feilslått EU-politikk truer kvaliteten til det norske helsevesenet. Norge kan lære av å se til Sveits, som etter mye lobbyvirksomhet fra industrien har forsikret seg mot konsekvenser av denne politikken.
Denne artikkelen er mer enn to år gammel.

DET SISTE ÅRET har det vært stor oppmerksomhet om nordmenn som har flyttet til Sveits, og med et sterkt søkelys på at dette er et «svik» mot landet de har bygget seg opp i. Dogmatismen er at Norge er verdens beste land å bo i, og at den eneste grunnen til å flytte Sveits, er en griskhet ved å unngå skatt. Det er mye bra i Norge, spesielt med velferdssystemet vårt fordi helse er en hjørnestein.
I forbindelse med H.M. Kong Haralds innleggelse på Rikshospitalet den 19. desember kom tidligere statsminister Erna Solberg (H) med påstanden om at «heldigvis har vi verdens beste helsevesen». Dette samsvarer med en rangering fra 2021, utført av The Common Wealth Fund.
Nå er imidlertid realiteten at feilslått EU-politikk truer kvaliteten til det norske helsevesenet.
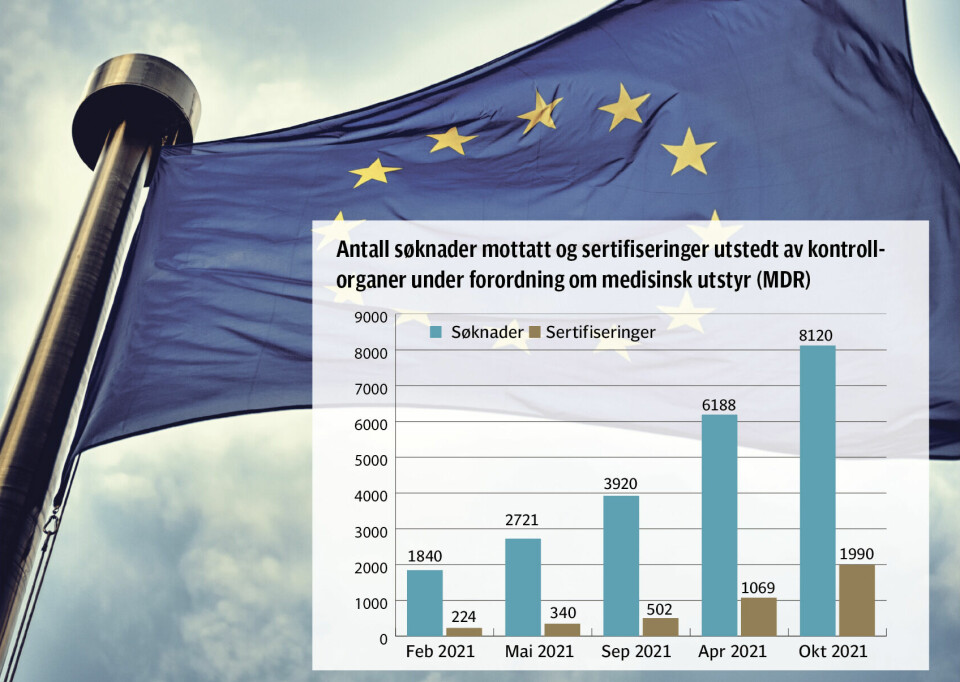
MANGLENDE FORSTÅELSE. I mai 2021 ble det nye europeiske regelverket for medisinsk utstyr (MDR 2017/745) iverksatt med en overgangsperiode frem til mai 2024. Dessverre har byråkratenes manglende forståelse av industrien ført til lange køer hos de private tekniske kontrollorganene (e.g. TÜV, BSI), hvor det i 2022 var fire ganger så mange godkjennelsessøknader som sertifiseringer.
Dette innebærer at mange produkter ville ha blitt tatt av markedet i 2024 ettersom de ikke vil få godkjennelse i tide, samtidig som det er praktisk umulig for nye terapier å bli godkjent. Det har også oppstått en større «skyggekø» av produkter hvor produsenten ikke vurderer det europeiske markedet.
Det mest logiske for oss er å nedprioritere Norge og EU. Det betyr at nordmenn ikke får tilgang til norskutviklet teknologi
EU har nå utvidet overgangsperioden til slutten av 2027 for høyrisiko-produkter, og 2028 for produkter med lavere risiko. Dessverre kommer denne endringen litt for sent, og den adresserer ikke vesentlige problemer rundt kompleksiteten i regelverket, samt kapasiteten til kontrollorganene. Dette betyr at et mindre antall medisinsk utstyr vil være godkjent i Norge, og nye terapier vil ikke bli tilgjengelige for oss. Etter mye lobbyvirksomhet fra industrien har Sveits forsikret seg mot denne feilslåtte EU-politikken, og Norge bør lære fra dem.
FORUTSIGBART PROBLEM. De som er kjent med industrien, har lenge sett problemet komme, noe som har ført til at de fleste produsenter har valgt ikke å prioritere det europeiske markedet. En fersk rapport fra BCG og UCLA viser at dette er konsensusen blant produsenter av medisinsk utstyr.
Av deltakerne i undersøkelsen deres sa 89 prosent at de vil prioritere det amerikanske markedet framfor EU, og 23 prosent sier også at de vil prioritere Japan og Kina foran EU. Dette betyr at nye innovative terapier ikke vil bli tilgjengelig i Norge eller EU, noe som vil redusere kvaliteten på vårt helsevesen – sammenlignet med for eksempel USA og Sveits.
KONSEKVENSENE. Hovedargumentet i rapporten er at det nye europeiske regelverket er for avansert – og uforutsigbart – til at det er verdt risikoen. Som andre norske Medtech-entreprenører kjenner jeg meg igjen i disse argumentene, og suksessen vår er truet av at vi, som små, nyetablerte firmaer, kommer bak de store Medtech-selskapene i køen hos de tekniske kontrollorganene. Dette betyr lenger tid før vi får inntekter, og vi må ha mer kapital for å dekke driftskostnadene frem til kommersialisering av våre produkter. Vi har bygget oss opp med støtte fra norske investorer, Innovasjon Norge, og Forskningsrådet, og ved konkurser risikerer vi å kaste bort både privat og offentlig norsk kapital.
Det mest logiske for oss er å nedprioritere Norge og EU. Det betyr at nordmenn ikke får tilgang til norskutviklet teknologi.
SÅRT BEHOV FOR BEDRE TERAPIER. Vår motivasjon for å utvikle medisinsk utstyr, er å gi pasienter bedre behandling, enten ved forbedret effekt eller redusert kostnad for behandlingen.
Med en eldrebølge og antibiotikaresistens truende i horisonten er det et sårt behov for bedre terapier. For å kunne møte det store og voksende behovet for medisinsk behandling må det innoveres, og nye produkter må tilgjengeliggjøres for markedet.
EUs nye regelverk har redusert innovasjonen i det europeiske markedet, og den gjenværende innovasjonen for medisinsk utstyr er til stor grad inkrementell. Det betyr at hvis du som privatperson ønsker deg den beste behandlingen i årene fremover, må du mest sannsynlig dra som helseturist til ikke-europeiske land.
Konsekvensene av denne EU-politikken er at et mindre omfang av medisinsk utstyr blir godkjent i Norge, og nye terapier kommer ikke til å bli tilgjengelige for oss
NORGE HENGER ETTER. Sveits er Europas hub for medtek – med et stort økosystem for innovasjon og et meget fremoverlent investormiljø. Landet har også en sterk lobby – Swiss Medtech – som har overbevist den sveitsiske regjeringen om å anerkjenne amerikansk FDA-godkjenning for medisinsk utstyr i noe de beskriver som en prioritering av pasientbehandling.
Denne fremoverlentheten er noe den sveitsiske befolkningen tjener på – og blir en sikkerhetsmekanisme mot den feilslåtte implementeringen av det nye europeiske regelverket for medisinsk utstyr.
Det er ikke første gang Norge kommer bak i rekken for nye terapier. Under covid-pandemien kunne vi se tidligere gjenåpninger i Storbritannia og Israel fordi de valgte å godkjenne medikamentene via egne legemiddelverk, mens Norge ventet på European Medical Agency (EMA). Da var det snakk om noen uker bak, nå er det snakk om flere år.
LÆR AV SVEITS! Tilgangen på nye terapier er vitalt for å forbedre det norske helsevesenet. EUs nye regelverk er en trussel for denne forbedringen, og Norge bør være i forskudd av problemene det medfører. Min anbefaling er at norske politikere bør lære fra Sveits og anerkjenne amerikanske FDA-godkjenning på lik linje med EUs CE-merke for medisinsk utstyr.
For bedrifter som våre betyr dette at vi kan tilgjengeliggjøre våre innovasjoner i Norge – samtidig som de blir tilgjengelige i store markeder som USA. For den jevne nordmann er følgene at vi får tilgang til de beste terapiene i verden – årevis før andre europeiske land.
Interessekonflikt/disclaimer: Artikkelforfatteren opplyser at han har en fot i både den sveitsiske og norske MedTech-industrien. Han jobber som R&D-ingeniør for det sveitsiske firmaet IBI SA, og han er daglig leder og medgrunnlegger av NuPep AS, som har mottatt støtte fra NFR og Innovasjon Norge.
Dagens Medisin, fra Kronikk- og debattseksjonen i 04-utgaven.
















