Benmargskreft: – Daratumumab ga redusert risiko for progresjon
Resultater fra den første fase 3-studien på medikamentet viser effekt på progresjonsfri overlevelse.
Denne artikkelen er mer enn fem år gammel.
CHICAGO: En randomisert fase 3-studie som ble presentert under kreftkongressen ASCO 2016 søndag, har undersøkt effekten av legemiddelet daratumumab (Darzalex) i behandlingen av myelomatose med tilbakefall.
Studien har omfattet nærmere 500 pasienter, og konkluderer med at det å tilføye daratumumab til behandlingsregimet bortezomib (Velcade) og deksametason, resulterte i 61 prosent lavere risiko for progresjon av sykdommen.
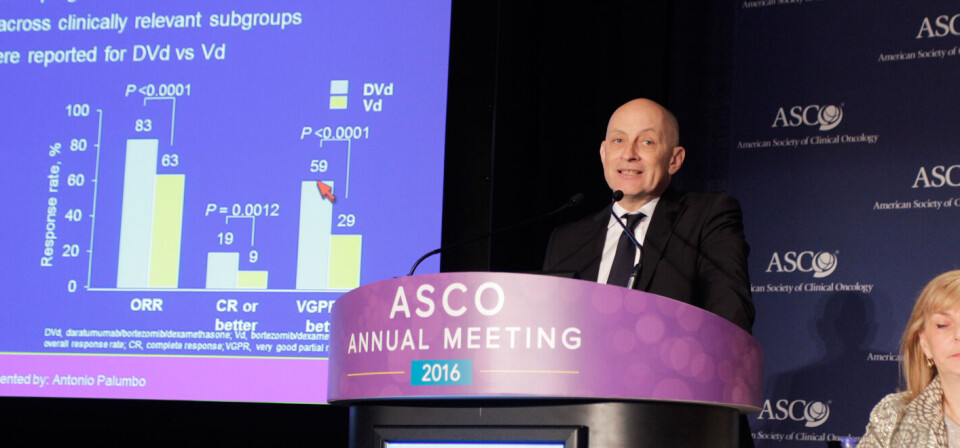
Bedre respons
I tillegg viser studien at pasientene som fikk daratumumab i tillegg til bortezomib og deksametason, fikk bedre responser enn pasientene som bare fikk bortezomib og deksametason.
– Dette er et medikament som har vært på vei inn en stund, uten at det har foreligget data fra fase 3-studier. Dette er den første fase 3-studien, og resultatene bekrefter de tidligere tegnene på at dette er et godt medikament, sier Anders Waage, overlege i hematologi ved St. Olavs hospital og professor ved NTNU.

Ikke sammenlignet med andre
Waage mener resultatene taler for at medikamentet blir brukt i behandlingen av norske pasienter. Han viser til at rundt 380 personer årlig får myelomatose i Norge. Av disse får rundt 80 prosent behandling for tilbakefall, og for denne pasientgruppen kan daratumumab være et aktuelt alternativ, ifølge Waage.
– Samtidig vil det komme flere andre medikamenter fremover, som vi vet er gode i kombinasjon med bortezomib eller andre medikamenter. Daratumumab er ikke sammenlignet med noen av disse.
Waage mener resultatene fra studien er lovende, men understreker at man må vente på data som viser at pasientene overlever lenger, før det er mulig å fastslå hvor godt medikamentet er.
Utvidet tilgang
Ved utgangen av mai fikk daratumumab betinget EU-godkjennelse. Dette innebærer at den europeiske legemiddelmyndigheten EMA vil gjøre årlige nytte-risiko-vurderinger av legemiddelet, frem til selskapet som markedsfører medikamentet, Janssen-Cilag, har levert dokumentasjon fra to fase 3-studier. Statens legemiddelverk har dessuten foreslått metodevurdering av daratumumab.
Legemiddelet har imidlertid vært tilgjengelig gjennom den såkalte «compassionate use»-ordningen i EU, som innebærer en begrenset tilgang til legemidler uten godkjenning dersom de oppfyller et ikke-oppfylt behov i behandlingen av svært alvorlige sykdommer.
– Per i dag har vi fire pasienter som blir behandlet med medikamentet på St. Olavs hospital, og vi har gode erfaringer med dette, sier Waage.
Oppgitte interessekonflikter: Anders Waage har vært med i advisory boards og holdt foredrag for flere selskaper som markedsfører legemidler mot myelomatose: Janssen-Cilag, Celgene, Novartis, Takeda.













